实用|高考化学一轮复习笔记
高二同学们过完这个暑假就要成为高三生,大家也都开始一轮复习了,那么高中化学一轮复习要注意什么?要复习什么呢?今天就开始给各位同学准备有关一轮复习的资料,同学们可以持续关注哦!
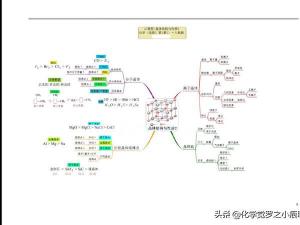
高考化学一轮复习笔记(详细)

必须掌握的化学思想与化学方法
1. 整体性原则:
——学会从整体出发,全面考虑问题;
2. 守恒意识:
——三大守恒内容:①质量守恒;②电荷守恒;③得失电子守恒
3. 平衡意识:
——勒夏特列原理适用于一切平衡体系(化学平衡、电离平衡、水解平衡、溶解平衡等)
4. 合理性原则
——要学会运用常识、常理解题,要学会识别社会常理。杜绝不合逻辑的常识性错误
5. 绿色化学思想
——①原子经济性;②杜绝污染源
6. 组成分析
——组合与拆分;反应物、生成物的分子组成变化
7. 特征反应(关注典型反应)
——解决问题的突破口;题眼、关键字
8. 具体化
——可使问题意外地简单

化学知识体系网络
第一部分 基本概念与基本理论

(一) 物质的组成
1、分子和由分子构成的物质
⑴分子是构成物质的一种能独立存在的微粒,它保持着这种物质的化学性质
分子有一定的大小和质量;分子间有一定距离;分子在不停地运动着(物理变化是分子运动状态改变的结果);分子间有分子间作用(范德华力)。
⑵由分子构成的物质(在固态时为分子晶体)。
一些非金属单质(如H2、O2、Cl2、S、惰性气体等);气态氢化物;酸酐(SiO2除外);酸类和大多数有机物等。
2、原子和由原子构成的物质
⑴原子是参加化学变化的最小微粒。化学反应的实质是原子的拆分和化合,是原子运动形态的变化
原子有一定的种类、大小和质量;由原子构成的物质中原子间也有一定间隔;原子不停地运动着;原子间有一定的作用力。
⑵由原子构成的物质(固态时为原子晶体)。
金刚石、晶体硅、二氧化硅、碳化硅(SiC)等。
3、离子和由离子构成的物质
⑴离子是带有电荷的原子或原子团。带正电荷的阳离子如Na+、Fe3+、H3O+、NH4+、[Ag(NH3)2]+等;带负电荷的阴离子如Cl-、S2—、OH—、SO42—、[Fe(CN)6]3—等。
⑵由离子构成的物质(固态时为离子晶体)。
绝大多数盐类(AlCl3等除外);强碱类和低价金属氧化物等是由阳离子和阴离子构成的化合物。
【注意】离子和原子的区别和联系:离子和原子在结构(电子排布、电性、半径)和性质(颜色,对某物质的不同反应情况,氧化性或还原性等)上均不相同。

(二) 物质的分类
1、元素
⑴元素是具有相同核电荷数(即质子数)的同一类原子的总称(元素的种类是由核电荷数或质子数决定的)。
人们把具有一定数目的质子和一定数目的中子的一种原子叫做核素,同一元素的不同核素之间互称为同位素。
⑵元素存在状态
① 游离态——在单质中的元素
由同种元素形成的不同单质——同素异形体,常有下列三种形成方式:

组成分子的原子个数不同:如O2、O3;白磷(P4)和红磷等
晶体晶格的原子排列方式不同:如金刚石和石墨
晶体晶格的分子排列方式不同:如正交硫和单斜硫
② 化合态的元素——在化合物中的元素
【注意】元素和原子的区别,可从概念、含义、应用范围等方面加以区别。
(四) 氧化还原反应
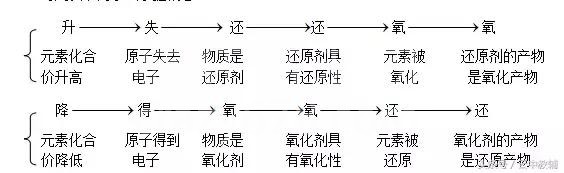
1、氧化还原反应的特征:
元素化合价有无升降,这是判断是否是氧化还原反应的依据。
2、氧化还原反应各概念间的关系
可用以下两条线掌握概念
3、物质有无氧化性或还原性及其强弱的判断
⑴物质有无氧化性或还原性的判断
元素为最高价态时,只具有氧化性,如Fe3+、H2SO4分子中+6价硫元素;元素为最低价态只具有还原性,如Fe、S2—等;元素处于中间价态既有氧化性又具有还原性,如Fe2+、SO2、S等。
⑵物质氧化性或还原性相对强弱的判断
① 由元素的金属性或非金属性比较
金属阳离子的氧化性随单质还原性的增强而减弱,如下列四种阳离子的氧化性由强到弱的顺序是:Ag+>Cu2+>Al3+>K+。
非金属阴离子的还原性随单质氧化性的增强而减弱,如下列四种卤素离子还原性由强到弱的顺序是:I->Br->Cl->F-。
② 由反应条件的难易比较
不同氧化剂与同一还原剂反应,反应条件越易,氧化性越强。如F2和H2混合在暗处就能剧烈化合而爆炸,而I2与H2需在不断加热的情况下才能缓慢化合,因而F2的氧化性比I2强。
不同还原剂与同一氧化剂反应,反应条件越易,还原性越强,如有两种金属M和N均能与水反应,M在常温下能与水反应产生氢气,而N需在高温下才能与水蒸气反应,由此判断M的还原性比N强。
③由氧化还原反应方向比较
还原剂A+氧化剂B

氧化产物a+还原产物b,则:
氧化性:B>a 还原性:A>b
如:由2Fe2++Br2=== 2Fe3++2Br-
可知氧化性:Br2>Fe3+;还原性:Fe2+>Br-
④当不同的还原剂与同一氧化剂反应时,可根据氧化剂被还原的程度不同来判断还原剂还原性的强弱。一般规律是氧化剂被还原的程度越大,还原剂的还原性越强。同理当不同氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。如氯|气、硫两种氧化剂分别与同一还原剂铁起反应,氯|气可把铁氧化为FeCl3,而硫只能把铁氧化为FeS,由此说明氯|气的氧化性比硫强。
4、氧化还原方程式配平
原理:氧化剂所含元素的化合价降低(或得电子)的数值与还原剂所含元素的化合价升高(或失电子)的数值相等。
步骤Ⅰ:写出反应物和生成物的分子式,并列出发生氧化还原反应元素的化合价(简称标价态)
步骤Ⅱ:分别列出元素化合价升高数值(或失电子数)与元素化合价降低数值(或得电子数)。(简称定得失)
步骤Ⅲ:求化合价升降值(或得失电子数目)的最小公倍数。配平氧化剂、还原剂、氧化产物、还原产物的系数。
步骤Ⅳ:用观察法配平其他物质的系数。
Tags:笔 高考 性
相关文章
-
2025-10-14

最新高中化学方程式大全324组|高中三年都用得上!
最全汇总,赶快收藏
-
2025-09-08
高中化学“必修一”考点大全
一、熟悉化学实验基本操作危险化学品标志,如酒精、汽油——易燃液体;浓H2SO4、NaOH(酸碱)——腐蚀品二、混合物的分离和提纯:1、分离的方法:①过滤:固体(不溶)和液体的分离。②蒸发:固体(可溶)和液体分离。③蒸馏:沸点不同的液体混合物的分离。④分液:互不相溶的液体混合物。⑤萃取:利用..
-
2025-09-02

高中化学不好?元素周期表记忆口诀教给你
第一个周期:氢氦(轻咳\侵害)即背诵它很轻松。第二周期:锂铍硼碳氮氧氟氖(狸皮捧炭蛋养弗奶):前一句是用狐狸皮捧木炭,后一句是说凡是从蛋里养的都不吃奶。第三周期:钠镁铝硅磷硫氯氩(拉美旅归,林柳路呀):一个人从拉丁美洲旅行回来,道路上有很多柳树第四周期:钾钙钪钛钒铬锰铁钴镍铜锌..
猜你喜欢
-
2020-09-05
高考历史都考啥?划重点,知识点都给您总结好啦!
高中历史知识点总结第一弹!更多资料获取,请关注公众号“灵虎优学汇”。更多精彩等着您!一、中国早期政治制度的特点(一)西周分封制1、分封的目的:为巩固周王朝的统治2、分封的国家:鲁、齐、燕、卫、宋、晋3、分封的对象:王族、功臣和先代贵族(商代后裔)其中,同姓贵族(即姬姓)是分封的主..
-
2018-08-19
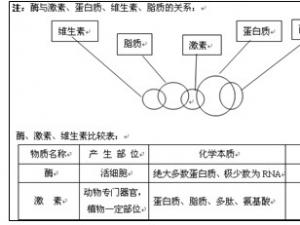
高一生物知识点归纳:酶和atp知识网络
1、美国科学家萨姆纳通过实验证实酶是一类具有催化作用的蛋白质,科学家切赫和奥特曼发现少数RNA也具有生物催化作用。总之,酶是活细胞产生的一类催化作用的有机物,胃蛋白酶、唾液淀粉酶等绝大多数的酶是蛋白质,少数的酶是RNA。不能说所有的蛋白质和RNA都是酶,只是具有催化作用的蛋白质或RNA,才..
-
2025-09-30

高中数学必修1-5各章常考知识点全整理!学渣看完后也能考120+..
高中数学必修1-5各章常考知识点全整理!学渣看完后也能考120+>第一章】集合和函数的基本概念这一章的易错点,都集中在空集这一概念上,而每次考试基本都会在选填题上涉及这一概念,一个不小心就会丢分。次一级的知识点就是集合的韦恩图、会画图,掌握了这些,集合的“并、补、交、非”也就解决了。..
-
2020-01-22
我们一会就把他拖进来
1、一天爸爸到儿子大学所在的城市出差,想给他个惊喜。大清早去他们宿舍,礼貌的敲敲门,问,“这是×××的宿舍吗?”里面沉默了几秒钟,就听一个人吼了声:“把他扔门口吧!我们一会就把他拖进来!!12、有天晚上,在路上遇到一只小猫,还在喝奶期的那种,很可爱。一美眉想抱回宿舍养,可是宿舍..
-
2020-11-20
世事很多彩,生活真幽默
1、不愿与世俗同流合污的人基本都抑郁了。2、所有命运赠送的礼物,早已在暗中标好了价格。3、这个时代的手机电量让人们平等地过着一种捉襟见肘的生活。4、我从不知道顺其自然有多自然,但我知道现实有多现实。5、人生三大真理:暴力真的可以解决一切,帅真的可以当饭吃,有钱真的可以为所欲为。。。..