收藏丨高一化学计算题常用解题技巧和方法!
还有54天」
高一化学中计算类型比较多,其中有些计算经常考查,如能用好方法,掌握技巧,一定能达到节约时间,提高计算的正确率。
1差量法
例题. 将质量为100克的铁棒插入硫酸铜溶液中,过一会儿取出,烘干,称量,棒的质量变为100.8克。求有多少克铁参加了反应。
解析:
Fe + CuSO4= FeSO4+Cu 棒的质量增加
56 64 64-56=8
m (Fe) 100.8g-100g=0.8g
56∶8=m (Fe)∶0.8
答:有5.6克铁参加了反应。
归纳小结
差量法是根据物质变化前后某种量发生变化的化学方程式或关系式,找出所谓“理论差量”,这个差量可以是固态、液态物质的质量、物质的量之差。,也可以是气态物质的体积、物质的量之差等。。该法适用于解答混合物间的反应,且反应前后存在上述差量的反应体系。差量也是质量守恒定律的一种表现形式。仔细分析题意,选定相关化学量的差量。质量差均取正值。差量必须是同一物理量及其单位,同种物态。
差量法优点:不需计算反应前后没有实际参加反应的部分, 因此可以化难为易、化繁为简。解题的关键是做到明察秋毫,抓住造成差量的实质,即根据题意确定“理论差值”,再根据题目提供的“实际差量”,列出正确的比例式,求出答案。
差量法利用的数学原理:差量法的数学依据是合比定律,即
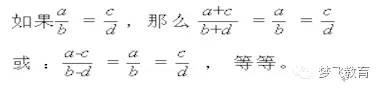
差量法适用范围
⑴反应前后存在差量且此差量易求出。
只有在差量易求得时,使用差量法才显得快捷,否则,应考虑用其他方法来解。这是使用差量法的前提。
⑵反应不完全或有残留物时,在这种情况下,差量反映了实际发生的反应,消除了未反应物质对计算的影响,使计算得以顺利进行。
经典习题
1.在稀H2SO4和CuSO4的混合液中,加入适量铁粉,使其正好完全反应。反应后得到固体物质的质量与所加铁粉的质量相等。则原混合液中H2SO4和CuSO4的质量比为 ( )
A.7:8 B.8:7 C.7:80 D.80:7
2.标准状况下,把4.48 L CO2通过一定量的过氧化钠固体后收集到3.36 L气体,则3.36L气体的质量是( )
A.4.8 g B.5.4 g C.6.0 g D.6.6 g
3.常温下盛有20mL的NO2和NO组成的混合气体的大试管倒立在水中,充分反应后,剩余气体的体积为16mL气体,则原混合气体中,NO2和NO的体积分别是多少?
2 守恒法
化学反应的实质是原子间重新组合,依据质量守恒定律在化学反应中存在一系列守恒现象,如:质量守恒、原子守恒、元素守恒、电荷守恒、电子得失守恒等,利用这些守恒关系解题的方法叫做守恒法。
守恒法包括
(1).质量守恒就是化学反应前后各物质的质量总和不变,在配制或稀释溶液的过程中,溶质的质量不变。
(2).原子守恒即反应前后主要元素的原子的个数不变,物质的量保持不变。元素守恒即反应前后各元素种类不变,各元素原子个数不变,其物质的量、质量也不变。
(3).电荷守恒即对任一电中性的体系,如化合物、混和物、溶液、胶体等,电荷的代数和为零,即正电荷总数和负电荷总数相等。
(4).得失电子守恒是指在发生氧化-还原反应时,氧化剂得到的电子数一定等于还原剂失去的电子数。
1
原子(离子)守恒
例题1 有0.4g铁的氧化物, 用足量的CO 在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到0.75g固体沉淀物,这种铁的氧化物的化学式为( )
A. FeO B. Fe2O3
C. Fe3O4 D. Fe4O5
解析 由题意得知,铁的氧化物中的氧原子最后转移到沉淀物CaCO3中即n(CO)=n(CO2)=n(氧化物中O原子)=n(CaCO3)=0.0075mol,m(O)=0.0075mol×16g/mol=0.12g。m(Fe)=0.4g-0.12g=0.28g,n(Fe)=0.005mol。n(Fe)∶n(O)=2:3,选B
例题2 将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到 1.68L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为( )
A.1.5mol/L B. 0.5mol/L
C. 2mol/L D. 1.2mol/L
解析 粗看题目,这是一利用关系式进行多步计算的题目,操作起来相当繁琐,但如能仔细阅读题目,挖掘出隐蔽条件,不难发现,反应后只有Na2SO4存在于溶液中,且反应过程中SO42―并无损耗,根据
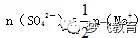
,则原硫酸的浓度为:2mol/L,故选C。
归纳小结:
“原子守恒法”是化学计算中必须高度重视的一种基本方法,也是一种重要的解题技巧。当遇到两种以上物质组成的混合物和涉及多个反应的计算题时,按常规方法计算需要先书写化学方程式,然后列方程组解方程,这种常规的计算方法,步骤很多,非常繁琐,需消耗大量的时间解一道题。若采用“原子守恒法”解题,思路清晰,步骤少,省时,大大地提高了解题的速率,能收到事半功倍的效果。
2
电荷守恒
溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,即:阳离子物质的量(或浓度)与其所带电荷数乘积的代数和等于阴离子物质的量(或浓度)与其所带电荷数乘积的代数和。

3
得失电子守恒法
例题1.用0.1 mol / L的Na2SO3溶液30 mL,恰好将2×10-3 mol的
还原,则元素X在还原产物中的
化合价是 ( )
A.+1 B.+2
C.+3 D.+4
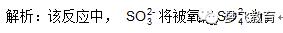
0.1 mol / L×30×10-3 L×2=2×10-3mol×(7-x),x=4
例题2、某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,生成NO,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为 ( )
A. 4∶1 B. 2∶1 C. 1∶1 D. 3∶2

3极值法
“极值法”即 “极端假设法”,是用数学方法解决化学问题的常用方法,一般解答有关混合物计算时采用。可分别假设原混合物是某一纯净物进行计算,确定最大值、最小值,再进行分析、讨论、得出结论。
例题 有锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是 ( )
A.锌 B.铁 C.铝 D.镁
解析:Zn—H2↑ Fe—H2↑ 2Al—3H2↑ Mg—H2↑
若单独跟足量盐酸反应,生成11.2LH2(标准状况)需各金属质量分别为:Zn∶32.5g;Fe∶28 g;Al∶9g;Mg∶12g。其中只有铝的质量小于10g,其余均大于10g,说明必含有的金属是铝。应选C。
联系我们
老师的:ziluolanzz
高中化学QQ:1656784903
高中化学:gaozhonghuaxue100
Tags:高一 关系式 硫酸铜 正确率 铁棒
相关文章
-
2023-07-19
高中化学关于乙醇性质几点误区的辨析
乙醇是重要的烃的衍生物,我们学习时一定要深刻理解羟基官能团在乙醇性质中的决定作用,同时又要避免由于某种思维定势引起的认识障碍和思维误区。只有及时澄清这些片面的错误的概念,才能更透彻理解乙醇的性质。误区一、乙醇能与钠反应,也能与氢氧化钠反应。解析:乙醇分子中存在羟基,和水、酸一..
-
2021-01-27
高考化学有机推断题“特殊”知识助力快速解题,冲刺高分!
高考化学最后一个大题往往是有机推断题,分值一般在10分以上,由几个小题组成,有机推断题主要涉及:有机物的结构简式、分子式推断;所含官能团名称;命名;反应条件;同分异构体书写;某化合物的化学性质(能否发生加成、氧化、加聚、缩聚反应,能否与Na、NaOH、Na2CO3、NaHCO3、溴单质、银氨溶液..
-
2020-01-26

高一化学必修一,最新视频教程大放送,学习化学不再难
1.教学内容高一化学模块I主要知识及化学方程式一、研究物质性质的方法和程序1.基本方法:观察法、实验法、分类法、比较法2.基本程序:第三步:用比较的方法对观察到的现象进行分析、综合、推论,概括出结论。二、钠及其化合物的性质:1.钠在空气中缓慢氧化:4Na+O2==2Na2O2.钠在空气中燃烧:2Na..
猜你喜欢
-
2020-02-14

高三孩子注意:这4类考试和高考同样重要,不少同学都不在意
高考是人生里面的一件大事,其实除了高考以外的考试,还有四个考试也很重要。因为我们在高考考出的成绩决定了你的人生方向、就业前景和发展方向,不过在我们高中的阶段,除了高考,还有更重要的考试,你还不知道?1、高一文理科考试随着高考的改革,不少的地区也实施了文理科目改革。如果当时选错了..
-
2019-04-01
找老婆要找在家做家务的
1、公司老总真威风,带着小秘全球通;部门经理多风情,带着二…奶神州行;部门主任也不傻,带着恋人充值卡;一般员工兜里空,带着老婆本地通。2、不到长城非好汉,到了长城吧,好汉不吃眼前亏;不撞南墙不回头,撞了南墙吧,墙倒又被众人推;不到黄河心不死,到了黄河吧,跳进黄河洗不清!烦恼不会..
-
2020-08-31
2016届上杭一中高三语文12月月考试卷含答案解析
考试时间:150分钟试卷满分:150分钟第I卷阅读题甲必考题一、现代文阅读(9分,每小题3分)阅读下面文字,完成小题。人民日报评论部:谁来加厚信息时代的文化土层?——创造一个更好的中国新技术当真是最伟大的“改变者”。如果以山峰为喻,从山脚的村歌社鼓,到山巅的阳春白雪,不同层次、不同人群..
-
2023-08-21

盘点:高中生物易错知识点“清单”!教你学会“理科中的文科..
这世上有两样东西是抢不走的:一是藏在心中的梦想,二是读进大脑里的书。大家好,我是雨桐,一个专注高中学习的小姐姐,一个内心热情洋溢,乐观向上永远十八岁的小姐姐!每日分享高效学习方法、快速解题技巧、高考出题规律等,欢迎大家的关注哦!高中生物,常被我们誉为理科中的文科,因为它不仅有..
-
2025-09-30
各式各样的幽默笑话
1、小林和小李交谈甚欢,谈到做事的方法时,小林说:“对于别人讲的话只相信一半,这就是我今天能成功的原因。”小李却说:“我跟你正好相反。我对别人讲的总会加倍相信,我今天照样也很成功。”小林听了十分吃惊,立刻问道:“啊,有这样的事吗?请问你现在那里高就?”“税务局。”2、CNN记者:尊..