高考化学高频考点有哪些
高三的同学已经距离高考越来越近了,同学们已经进入了化学全面复习阶段,这时候我们就应该有所侧重的来复习。纵观近几年高考命题,一直以基础题为主,所以要掌握更多的高考化学的高频考点及基础知识,因此,小编梳理了近几年高考化学的高频考点,希望能帮助广大的高考生。
高考化学高频考点如下
Ⅰ、基本概念与基础理论:
一、阿伏加德罗定律
1.内容:在同温同压下,同体积的气体含有相同的分子数。即“三同”定“一同”。
2.推论
(1)同温同压下,V1/V2=n1/n2(2)同温同体积时,p1/p2=n1/n2=N1/N2
(3)同温同压等质量时,V1/V2=M2/M1(4)同温同压同体积时,M1/M2=ρ1/ρ2
注意:①阿伏加德罗定律也适用于不反应的混合气体。②使用气态方程PV=nRT有助于理解上述推论。
3、阿伏加德罗常这类题的解法:
①状况条件:考查气体时经常给非标准状况如常温常压下,1.01×105Pa、25℃时等。
②物质状态:考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3等。
③物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及希有气体He、Ne等为单原子组成和胶体粒子,Cl2、N2、O2、H2为双原子分子等。晶体结构:P4、金刚石、石墨、二氧化硅等结构。
二、离子共存
1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
4.溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存;Fe3+与不能大量共存。
5、审题时应注意题中给出的附加条件。
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
②有色离子MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+。③MnO4-,NO3-等在酸性条件下具有强氧化性。
④S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O
⑤注意题目要求“大量共存”还是“不能大量共存”。
6、审题时还应特别注意以下几点:
(1)注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-与Cl-在强酸性条件下也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
(2)酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。
如HCO3-+OH-=CO32-+H2O(HCO3-遇碱时进一步电离);HCO3-+H+=CO2↑+H2O
三、离子方程式书写的基本规律要求
(1)合事实:离子反应要符合客观事实,不可臆造产物及反应。
(2)式正确:化学式与离子符号使用正确合理。
(3)号实际:“=”“”“→”“↑”“↓”等符号符合实际。
(4)两守恒:两边原子数、电荷数必须守恒(氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等)。
(5)明类型:分清类型,注意少量、过量等。
(6)检查细:结合书写离子方程式过程中易出现的错误,细心检查。
四、氧化性、还原性强弱的判断
(1)根据元素的化合价
物质中元素具有最高价,该元素只有氧化性;物质中元素具有最低价,该元素只有还原性;物质中元素具有中间价,该元素既有氧化性又有还原性。对于同一种元素,价态越高,其氧化性就越强;价态越低,其还原性就越强。
(2)根据氧化还原反应方程式
在同一氧化还原反应中,氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。
(3)根据反应的难易程度
注意:①氧化还原性的强弱只与该原子得失电子的难易程度有关,而与得失电子数目的多少无关。得电子能力越强,其氧化性就越强;失电子能力越强,其还原性就越强。
②同一元素相邻价态间不发生氧化还原反应。
常见氧化剂:
①、活泼的非金属,如Cl2、Br2、O2等;
②、元素(如Mn等)处于高化合价的氧化物,如MnO2、KMnO4等
③、元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3等
④、元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3、K2Cr2O7
⑤、过氧化物,如Na2O2、H2O2等。
Tags:加德罗 加德 考点 温同压 摩尔 三同 辛烷
相关文章
-
2025-09-10
高考化学选择题满分攻略 七个题型三个步骤妥妥拿满分!
要想化学考试拿高分,选择题非常重要。往年高考都突出化学主干知识的考查,如:氧化还原反应、离子反应、热化学、阿伏加德罗常数、元素周期律、电化学、化学反应速率和化学平衡等。那么,化学的选择题要怎么做才能拿高分呢?万朋教育小编结合化学选择题的特点和类型,谈一谈如何利用三步突破化学选..
-
2023-08-28
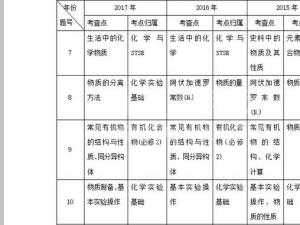
2018年高考化学全国卷选择题命题基本分析
【命题分析】由下表统计可以看出,高考化学7个选择题的命制是非常规律的。主要集中在物质的量、元素与化合物、物质结构与元素周期律、电化学、水溶液中的离子平衡、有机化合物(必修2)、化学实验基础这7个经典题型,题型、难度以及涉及的知识点都相对稳定,命题的对基础知识和基本能力的考查要求较高..
-
2021-05-07

高考化学一轮复习——19 元素周期律和元素周期表
《元素周期律和元素周期表》想必大家都很熟悉,毕竟在初三时化学老师可是使劲儿让背的内容啊!又经过了这么多年的学习,想必对这张元素周期表是相当的熟悉吧。本套资料完全免费!领取资料步骤:1、由于是总结更新资料,资料需求量大,请在下方评论区留下你的评论:“我想领取高思环球教育高考化学一..
猜你喜欢
-
2019-12-25
有感于生活的逗笑雷句
1、我觉得邮政就挺好,去年我在网上买了些种子,送来的时候是几盆花。2、上班休息好了,下班才有精神。3、爱情这玩意儿就是冰淇淋:好吃,好看,但是容易融化。4、婚姻这玩意儿就像热糖饼:管饱,够甜,但是经常烫嘴。5、正因为有了压力,喷泉才比普通的水更美丽。6、见到帅哥我就一直看一直看,看..
-
2020-02-14
很冷的包青天笑话版
1、包拯:公孙先生,你说说开封府是什么?公孙策(不假思索):回大人,开封府就是学生的亲人,学生的母亲~~~包拯(捋胡须,点头):恩,你回答得很好,开封府就是你的母亲,你应该热爱她!!展昭看了一眼包拯,哆嗦了一下!包拯:展护卫,你说,开封府是什么?展昭(颤颤巍巍):回大人,开封府是公..
-
2019-04-01
连公文包都不见了
1、再说个我小时候的吧!大家都知道带大梁的大二八自行车吧!以前四五岁那会儿都是直接坐在爸爸自行车的大梁上,偏着坐的,时间长了脚会麻,很难受!终于有一次去姥姥家,我提议坐后座,因为那样脚不会麻!同意了!哈哈,出发!!结果到目的地的时候杯具发生了…老爸把我忘记了,直接从后边把腿迈下..
-
2019-12-15

白河高级中学2018年高考创历史最好成绩
用对的学习方法和学习技巧来学习,成绩自然就会提高,还好,有清华北大的伙伴们编写的《疯狂600提分笔记》解读高考出题规律,答题技巧,应试技巧等。图文:白河高级中学周耀山
-
2018-09-12
女人一定要对自己好点
1、吃自助最高境界:扶墙进,扶墙出。2、结婚必备条件:有车有房,父母双亡。3、没有钱,没有权,再不对你好点,你能跟我?4、拿份报纸上厕所,俺是读书人。5、上Google上百度一下。6、女人一定要对自己好点。一旦累死了,就会有别的女人花你的钱,住你的房,睡你的老公,打你的娃!7、你的丑和你的..